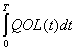|
「QOLを加味した生存期間」として、QALYsとQ-TWiSTの概念を紹介する。
QALYsとは、Qualtiy-Adjusted Life
Years(質調整生存年)のことで、同じ生存期間であっても、質(QOL)によってその価値が異なるという考えに基づき、生存期間(年)にQOLに応じた数値(0〜1)を掛け合わせることで算出される数字である。期待される生命の「質」と「量」とを、統合した一つの数字で表現する画期的な指標といえる。時間tに応じて変化するQOLを、0〜1の範囲で変動するQOL(t)という関数で表現するならば、QOL(t)を評価開始時点0から死亡時Tまでtで積分し、年単位で表したものがQALYsということになる(単位にかかわらず質調整生存を表すQAS:
Quality-Adjusted
Survivalの方が、OSやDFSとの整合性があって適切な表現と言えるが、ここでは、より広く使われているQALYsという言葉を用いて説明する)(図1)。
 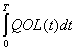
図1

これを、個々の患者さんについて正確に算出し、客観的なデータとして解析できるのであれば、優れた指標として確立するはずであるが、実際はそう簡単なものではない。日々変化するQOLを複数の患者さんについて統一した尺度で追いかけるのには限界がある。客観性を追求すれば、個々の患者さんの想いからは離れていくし、逆に、個々の患者さんの想いを反映させようとすれば、客観性を失い、臨床試験の指標としては役に立たなくなる。たとえば、「娘の結婚式に出席できたかけがえのない1日」というのは、個人レベルでは、治療方針を左右する重大な要素であるが、治療の意義を評価する臨床試験の指標に汲み入れるのは適切ではない。「客観的なQOL」とは、どこかで折り合いをつけなければ評価できないのである。
QOLは、様々な要素が絡み合い、時々刻々変動していくわけだが、臨床試験で評価するときには、正確な曲線を描くことはせず、単純化した直線に近似させることになる。ある健康状態にあるときのQOLを定数として決めてしまい、各個人について、その健康状態にいる時間を測定すれば、QALYsの算出は容易となる(図2)。
図2
しかし、単純化した健康状態の数値のみで人生の価値まで評価できるのか、いくつの健康状態を想定すれば妥当なものと言えるのか、という問題は残ってしまう。複雑化・個別化すれば評価・解析が困難となってしまうし、単純化・一般化すれば「等身大の人間のエンドポイント」からは遠ざかってしまう。そして、いずれの方向を目指しても、純粋な生存期間の評価と比較して、「客観性が乏しい」「恣意的だ」という批判を免れない。個々の患者さんのQOLを追求する人たちは、「個別に判断すればいいのであって、QOLを客観化させる必要はない」と言い、客観的な臨床試験を追求する人たちは、「QOLのような恣意的な指標は排除して客観性を確保すべきだ」と言い、QOLを臨床試験で評価しようというインセンティブはなかなか働かないようである。
QOLを生存期間の評価に反映させる試みは、臨床試験の考え方の本流とはなっていないが、一部の研究者によって細々と取り組まれてきた。その小さな流れの源流をたどってみると、1968年Klarmanらによる研究に行き着く6)。慢性腎不全の患者さんについて、腎臓移植を行った群と人工透析を続けた群とを比較する際、「腎臓移植成功後に得られた制限されることのない生存期間」に、「透析を続けながら過ごす同じ生存期間」よりも高い価値を置いたのである。1972年、米国の研究者らによってQALYsという形で紹介がなされ、1978年、イギリスでRosserら7)が29の健康状態を数字で評価する「Rosser
index」を発表したのちは、それが土台となって、主にイギリスを中心として発展を遂げた8)。
しかし、QALYsが主に用いられてきたのは、主に医療の経済効率が論じられるときであり、臨床試験のエンドポイントとして設定されたり、臨床上の意思決定に用いられたりする機会は極めて少ない。
私自身、臨床現場でこの概念のことを一度たりとも耳にしたことはなく、今回、この論文を書くに当たって、理想のエンドポイントを探し求め、論文上で初めて出会ったにすぎない。そして、文献検索をしてみると、ほとんどの論文において、経済効率や医療資源分配との関連で論じられているだけであり、また、臨床への応用については、否定的な論調であるものも目立った。日本の癌専門医の幾人かに尋ねてみても、批判的な意見がほとんどで、実際、国際学会でQALYsを用いた発表が冷ややかに受け止められている場面にも遭遇した。「理想のエンドポイント」を探し求めていた私には、期待はずれな現実であった。
文献検索をしてみて浮かび上がってくるのは、方法論上の問題と倫理上の問題である。
方法論上の問題点としては、まず、QOLや健康状態の重み付けの尺度が確立していないことが挙げられる。これまでにQALYsで用いられてきたQOLは健康関連の面に限られ、それ以外の「社会性」「実存性」にかかわる側面が評価されていないが、客観性を保つためにはこれもやむをえないこととされている。また、疾患やその治療に特異的な項目を評価する「疾患特異的尺度」と、特定の疾患に限定しない「包括的尺度」をどのように使い分けるか、という問題もある。前者では異なる疾患の患者さんを比較することはできず、後者では細かい変化を捉えることができない、といった欠点がある。
1989年頃になって、QALYsの算出に効用値(utility)を活用することが提案された。効用値とは、ある治療上の結果(アウトカム)に対して、各個人の選好(どの程度好ましく思うか)の度合いを0〜1の範囲で数値化したものである。これを生存期間に掛け合わせれば、QALYsが算出されることになる。効用値の測定には様々な方法が提案されている6)
9)。
<rating scale(評点尺度法)>
「死が0で完璧な健康が1とすると、今の健康状態はいくつで表現できますか?」という質問に直接答えてもらう方法である。数字を答えてもらったり、実物のものさしを用意して状態を示す位置を指差してもらったり、様々なバリエーションがある(「visual
analogue scale」「feeling thermometer」「verbal numeric
scale」など)。評価が容易で、実用的で、信頼性と妥当性も高い。QALYsにそのまま用いることのできる真の効用値ではないが、ある集団でrating
scaleの平均値をとったとき、真の効用値はその1.18倍すれば得られる(rating
scaleが0.85以上の場合の効用値は1とする)と報告されている10)。
<standard gamble(基準的賭け法)>
「完璧ではない健康状態」と「完璧な健康状態か死かの賭け」のどちらを選ぶか?という二択を想定する。確率pで完璧な健康状態が得られるが確率1-pで死ぬという賭けがあったとき、今の健康状態で妥協するか、その賭けに挑むか、というのを、pの値を変動させて考えれば、二択の選好が同等(「どちらでもいい」)となるときのpの値が今の健康状態の効用値ということになる。概念的に複雑であり、実用上の問題があるほか、回答者のリスクに対する態度、ギャンブラー的な性格の度合いが反映されてしまうという問題点も指摘されている。
<time trade-off(時間得失法)>
「ある完璧ではない健康状態での一定期間の生存」と「完璧な健康状態でのより短い期間の生存」のどちらを選ぶか?という二択を想定する。その選好が同等となるときの期間の比が効用値となる。standard
gambleよりもわかりやすいが、仮想状態を評価する必要がある点でやはり概念的である。
standard gambleとtime
trade-offは、異なる仮定や方法論を用いているにもかかわらず、それによって得られる効用値が類似したものであることがいくつかの臨床試験で示されている。
このほか、Person trade-off (状態Aのx人と、状態Bのy人のどちらを助けるべきか、という評価を重ねて効用値を決める)や、Magnitude
estimation (Aという状態はBという状態の何倍いやか、という評価を重ねて効用値を決める)や、Willingness to pay
estimates(ある健康状態に対してはいくら支払うか、という評価を重ねて効用値を決める)などの算出法がある。また、これらの異なる次元で算出された効用値をmulti-attribute
utility theoryで統合するmulti-attribute
utilities(多重属性効用値)というものも提案されている。また、健康関連QOLの質問表から効用値を算出する方法も試みられており、Quality of
Well-Being Index、Health Utility Index、EuroQol、Q-tility
Indexなどの指標が提案されている。しかし、これらのうち、どの方法を用いるのか、定まった見解はなく、議論が続いている。
理論上、効用値は0〜1の値をとることになっているが、たとえば、「抗癌剤で脱毛するなら死んだほうがまし」と考える人にとって、脱毛した状態の効用値はマイナスとなるだろうし、また、「娘の結婚式に出席する1日を過ごすことは100日長生きするよりも価値がある」と考える人にとって、その1日の効用値は100となるだろう。固定した効用値を用いると、これらの想いを汲み取ることができなくなる。
QALYsをめぐっては、方法論上の問題だけでなく、より根本的な、倫理上の問題点も指摘されている。La
Pumaらは、QALYsが使われる際に前提とされている6つの点を挙げ、批判している8)。
<前提1>QOLは正確に測ることができるものであり、資源分配を決定するときに活用される。
<前提2>功利主義(「最大多数の最大幸福」)は、資源分配のジレンマを解決するための適切な理論である。
<前提3>平等であることと有用であることとは両立しうるものであり、QALYsの構築においてバランスよく用いられる。
<前提4>社会の選好が、個々の患者の選好を代弁する。
<前提5>若くて健康な人に比べて、高齢で病気の人は、治療によって享受できる恩恵が小さい。
<前提6>医者は、患者が必要とするものと、使える医療資源とを分けて考え、一人の患者の擁護者になるよりも、社会全体の代弁者として行動できる。
(前提1に対して)QOLは、個人が自分で価値があると思う人生を送ることができるか、という点に焦点が置かれるべきであるが、QALYsではそれが評価されていない。
(前提2に対して)功利主義的倫理観では、人間的なケアよりも、測定可能な結果で医療が評価される。健康はモノとして扱われ、医療は、自由な患者-医師関係から、より標準化、定量化、規格化された外交儀礼へと移行してしまう。
(前提3に対して)政策決定者が、平等であることと有用であることとを無理やり結びつけて、臨床における決定の過程に一律の規制を設けるおそれがある。
(前提4に対して)個人にとって最も重要である自己決定権が、社会の利益よりも軽視されてしまう。個人の選考の多様性と曖昧さ、グループ化したときの誤用の可能性を考えると、QALYsの臨床応用は、患者にとって危険である。
(前提5に対して)高齢者、障害者、重症患者、末期患者が生きる価値が不当に低く評価されてしまう。
(前提6に対して)医者の仕事は、第一に、患者の医学的な必要性を満たすことであり、社会資源の保存が優先されるべきではない。
Doughertyらは、患者さんにQALYsの情報を与えることで、患者さんの自己決定権をサポートできるという期待を示しつつ、QALYsの結果を医者、行政者、政策決定者が患者に強制すればその逆のことが起こると危惧している11)。QALYsの概念が功利主義的改革を進める役割を果たせば、個人の幸福はないがしろにされ、個人はQALYsを運ぶ「乗り物」に成り下がってしまう。
ここで述べられていることは、要するに、QALYsはマクロのエンドポイントであって、等身大の人間のエンドポイントとはいえない、ということである。「1人の人間の1QALYと2人の人間の0.5QALYsは同等の価値である」なんてことが普通に論じられているのを見ると、これを等身大の人間のエンドポイントと呼ぶ気にはなれない。医療資源の分配というレベルではなく、この概念を個人レベルで構築しなおすことはできないのだろうか。患者さんの目線に立ち、その意思決定をサポートするような形で活用することはできないのだろうか。
論文検索を行っていくうちに、この問題にヒントを与えてくれるQ-TWiST (Quality-adjusted Time Without Symptoms
and Toxicity)
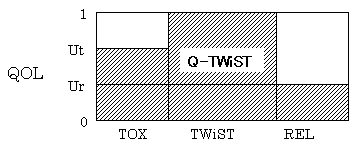
という概念に出会った。Q-TWiSTは、主に癌医療で用いられる指標で、評価開始時から亡くなるまでの生存期間を、治療による自覚的な副作用がある時期(TOX期:
toxicity)と、自覚的な副作用も癌による症状もなく過ごしている時期(TWiST期: time without symptoms and
toxicity)と、再発が認められてから死亡するまでの時期(REL期:
relapse)という3つの状態にわけるところがポイントである。TWiST期の効用値を1、死の効用値を0とし、TOX期とREL期の効用値を、それぞれUt,
Urで示すと、
Q-TWiST=Ut × TOX + 1 × TWiST + Ur × REL
という計算でQ-TWiSTが算出される。TOX
、TWiST、RELというのは、それぞれの期間の長さである。QALYsにおいて時間とともに変動する変数QOL(t)を、Ut、1、Urという3つの値に単純化させたものがQ-TWiSTの正体である(図3)。
図3
生きている限り効用値は1である(Ut=Ur=1)とすれば、Q-TWiSTは、生存期間
(OS: Overall Survival)と一致する。また、Ut=1、Ur=0とすると、Q-TWiSTは、無再発生存期間(DFS: Disease-Free
Survival)と一致する。逆に言うと、TOX、TWiST、RELの期間は、OSやDFSという、臨床試験で広く用いられている指標と、治療期間から簡単に算出することができる。
・TOX = 治療期間
(※副作用の問題とならない治療では、必ずしもイコールにはならない)
・TWiST = DFS – TOX
・REL = OS - DFS
変動するQOLをたった3つの状態に押しこめてしまうというのは、現実にそぐわないようにも思えるが、実は、この単純化は、患者さんの主観を反映させるためのしかけなのである。UtやUrは、定数ではなく、患者さんの価値観によって変動する変数であり、Q-TWiSTは、UtやUrの設定によって大きく様変わりすることになる。抗癌剤治療に苦しむのは死んでいるのと同じ(Ut=0)という人から、抗癌剤を受けていようがいまいが生きている価値は同じ(Ut=1)という人まであるし、それは、再発後の状態でも同様である。「私にとって、抗癌剤治療中の効用値は0.7、再発後の効用値は0.3」という患者さんには、その患者さんにとってのQ-TWiSTを計算することができる。なお、変数がUtとUrの2つだけになっているのは、後述するthreshold
utility analysisを容易にするためである。
Q-TWiSTの概念は、早期乳癌の手術後に行われる術後補助療法(抗癌剤治療やホルモン療法)の意義を評価するために、GelberとGoldhirschらによって1986年に提唱された。早期乳癌に対する術後補助療法が再発率を下げ、生存期間を延長させることは、これまでに数多く行われてきた臨床試験によって証明されている。1984年に発表された臨床試験Ludwig
IIIでは、閉経後、腋窩リンパ節転移陽性の乳癌患者463人を3つの治療群に無作為に割り付け、その結果を比較している(表1)12)。
表1
|
|
人数 |
7年DFS |
7年OS |
|
CMF+TAM |
154 |
51% |
57% |
|
TAM |
153 |
36% |
51% |
|
術後補助療法なし |
156 |
24% |
47% |
※ CMF: 乳癌に対する標準的な抗がん剤治療であるCMF 療法を12サイクル(12ヶ月間)行う。
※ TAM: 乳癌に対する標準的なホルモン療法であるタモキシフェン内服を12ヶ月間行う。
何もしないよりタモキシフェン内服をした方が成績がよく、タモキシフェンだけ内服するよりも、化学療法(CMF療法)を併用した方が成績がよい、という傾向が認められる。GelberとGoldhirschは、この臨床試験の解析において、新しいエンドポイントとしてTWiSTを提唱し13)、術後補助療法によって得られる生存期間の延長が、術後補助療法による副作用の苦しみに見合ったものであるのかどうかを調べるためにQ-TWiSTを用いた14)。それぞれの群の生存曲線を描き、0〜7年の生存曲線の下の領域をTOX、TWiST、RELの3つに分けてみると、図4のようになる。
図4(文献14のFig.2)
CMF+TAM
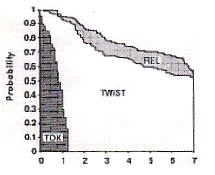
TAM
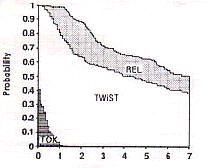
なし
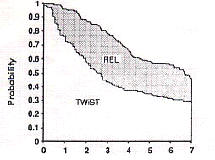
生存曲線の下の面積が生存期間の平均値(mean survival
time)と一致するのと同様、ここで示された各領域の面積は、それぞれの期間の平均値となる。各平均値と、それから計算されるQ-TWiSTを表2に示す(単位はヶ月)。
表2
|
|
TOX |
TWiST |
REL |
OS |
Q-TWiST
Ut=Ur=0.5 |
Q-TWiST
Ut=0,
Ur=1 |
|
CMF+TAM |
9.6 |
50.3 |
7.1 |
67.0 |
58.7 |
57.4 |
|
TAM |
2.0 |
47.1 |
12.9 |
62.0 |
54.6 |
60.0 |
|
なし |
0.0 |
41.5 |
20.9 |
62.4 |
51.9 |
62.4 |
生存期間については、CMF+TAM群で長い傾向がみられる。Q-TWiSTを、たとえばUt=Ur=0.5で計算してみると、CMF+TAM群で術後無治療群よりも有意に長くなっている。ところが、Ut=0,
Ur=1(術後治療の副作用を味わっている期間は死んでいるのと同じ、再発しても生きている価値は変わらない)で計算してみると、術後無治療群でQ-TWiSTが長い傾向がみられるようになる。このように、Ut、Urの値を動かすことで、各治療群の評価が入れ替わることがある。UtとUrの値によって、どの治療群のQ-TWiSTが最長となるかを示したのが図5であり、こういう分析を、threshold
utility analysisと呼ぶ。患者さんごとにUtやUrを設定して治療法の優劣をみることができるため、理論的には、各個人の価値観を反映した判断が可能となる。
図5(文献14のFig.3A)
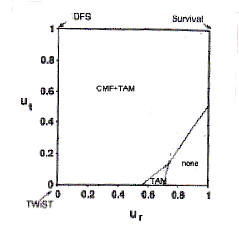
※
この図の実線によって治療の優劣がクリアカットに覆るのかというと、そうとは言えない。臨床試験のデータは、かなりの幅の誤差(真実の値との差)を含むのであり、境界線に近い部分については、治療の優劣を言うことはできない(統計学的有意差がない)。
Q-TWiSTは、乳癌術後補助療法のほか、エイズのzidovudine治療、メラノーマのインターフェロンα2b治療、直腸癌の放射線化学療法などの評価にも用いられている15)。Q-TWiSTのモデルは、次の4つの仮定の上に成り立っている16)。
(1) 健康状態の変化は、決まった順番で訪れる。
(2) ある健康状態の効用値は、時間がたっても一定である。
(3) ある健康状態の期間の長さに効用値を乗じたものが、その健康状態の「質調整期間」(Quality adjusted health state
duration)であり、正比例する。
(4) ある健康状態の効用値は、それ以前や以後のQOLの影響を受けない。
現実離れした感も否めないが、客観性を高めるためのぎりぎりの線とも言える。
Ludwig IIIを行ったのは、Goldhirschらが中心となっている欧米の臨床試験グループ(Ludwig Breast Cancer Study
Group)で、その後、IBCSG (International Breast Cancer Study
Group)と名前を変え、乳癌術後補助療法に関する臨床試験を多数行っている。
IBCSG
Vでは、リンパ節転移陽性の乳癌患者1229人(うち閉経前715人)について、術後補助療法としてCMF療法1サイクル(1ヶ月)と6サイクル(6ヶ月)の比較を行っている(表3)17)。
表3
|
|
7年DFS |
7年OS |
TOX |
TWiST |
REL |
OS |
Q-TWiST |
|
CMF×1 |
33% |
50% |
1 |
47 |
16 |
64 |
56 |
|
CMF×6 |
51% |
63% |
6 |
54 |
9 |
69 |
61 |
※ 単位はヶ月。表中のQ-TWiSTは、Ut=Ur=0.5で計算。
この臨床試験では、UtとUrを0〜1で変動させても、CMF6サイクルの優位性はほとんど揺るがない。このような場合には、すべての患者さんに対して、「CMF療法6サイクルが1サイクルよりも推奨できる」と説明してもよいと思われる(もちろん押し付けるわけではない)。
IBCSG
VIでは、リンパ節転移陽性、ステージIIの閉経前乳癌患者1475人について、術後補助療法としてCMF療法3サイクル(3ヶ月)と6サイクル(6ヶ月)の比較を行っている18)。その結果、6サイクルの方が3サイクルよりも、無病生存期間(DFS)が有意に長いという結果が示され、以後、「CMF療法は6サイクル行うべきで、短縮はすべきでない」という考え方が主流となっている。しかし、この臨床試験では、生存期間(OS)に有意差はなく、Q-TWiSTを検討してみると、Utが低い患者さんにとっては、3サイクルの方が優れている傾向もみられるようになる(表4、図6)15)。6サイクルを原則とするが、抗癌剤治療の負担が大きいような場合には、3サイクルへの短縮も妥当と考えられる。
表4
|
|
Tox |
TWiST |
REL |
DFS |
OS |
Q-TWiST |
|
CMF×3 |
3.8 |
40.1 |
9.8 |
43.9 |
53.6 |
46.9 |
|
CMF×6 |
6.4 |
39.7 |
8.0 |
46.1 |
54.1 |
46.9 |
※単位はヶ月。表中のQ-TWiSTは、Ut=Ur=0.5で計算。
図6
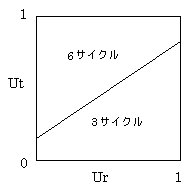
医者がUtやUrの値を動かして、「ある治療が優れている」と言うのは、明らかに恣意的である。UtやUrの値は、図を提示されるより前に患者さんが決めるべきであり、それを図の上にプロットすることにより、その患者さんの価値観において、どの治療が優れているかを判断することができる。
臨床試験では、計画段階で、プライマリーエンドポイントが設定され、治療の優劣はそれによって判断される。たとえ、他のエンドポイントに関して、ある治療の結果が上回っていたとしても、プライマリーエンドポイントとして設定されたものでない限り、治療の優劣の判断には使うべきではない。あとからエンドポイントをあれこれあてはめて解析すれば、「数打ちゃ当たる」的に、偶然優劣の差がつく場合もありえるからである。一般に、臨床試験で「有意な差がある」と言う場合、その差が95%以上の確率で真実を反映しているということである(p<0.05)。逆に言えば、真実ではないのに「差がある」と言ってしまう危険性が5%存在することになる。たとえば、本当は優劣の差がない2つの治療法について、独立した100個のエンドポイントを用意して調べつくせば、約5個のエンドポイントについて、「有意差あり」という結果が出てしまう。
Q-TWiSTは、UtやUrの組み合わせの数だけ(無限に)存在するエンドポイントであり、threshold utility
analysisを行えば、治療の優劣が覆るUtとUrの組み合わせが存在するのはむしろ当然とも言える。あらかじめ、「Ut=0.5、Ur=0.5でのQ-TWiSTをプライマリーエンドポイントとする」というように決めて臨床試験を行うのであれば、それを治療自体の優劣の評価に用いることができるかもしれないが、そのような臨床試験が、広く受け入れられるとは考えられない。つまり、Q-TWiSTは、治療自体の優劣を客観的に評価するためのエンドポイントとしては相応しくないのである。しかし、一人の患者さんにとっては、「客観的にどの治療が優れているか」よりも、「どの治療が自分の価値観に適しているか」という方が重要であり、その意味においては、Q-TWiSTは、患者さんに有用な情報を提供することになる。
先日、QALYsとQ-TWiSTの概念を、ある臨床試験グループの勉強会で提示したところ、次のような批判が浴びせられた。
(1) 日本では、生存期間などの「かたいエンドポイント」(評価者によるズレが少なく、客観性のある指標)をきちんと評価することもできていないのに、曖昧なQOLもあわせて評価するなんていうのは、時期尚早だ。まずは、かたいエンドポイントをきちんと評価できるような体制を整えることが先決で、今はQOLを考えるべきではない。
(2) 生存期間とQOLは別個に評価すればよく、強引に一つの指標にまとめる必然性がない。
(3) あまりに恣意的な指標であり、医者の意思決定には使えない。
日本ではQOL重視派が欧米以上に迫害されているということを実感させられた会であったが、めげずに、これらの批判について検討してみたい。
(1)については、確かにそういう現実があるが、かといって、最初からQOL評価を排除するのは短絡的である。生存期間がQOLと比べてより客観的に評価可能であるというのは事実であるが、それは、生存期間がQOLより重視されるべきだというのとは別次元の話である。実地医療においては、常に、患者さんのQOLを考慮した意思決定がなされるべきであり、たとえ、困難な道であっても、QOL評価を臨床試験に取り込む努力をしていくべきであろう。
なお、Q-TWiSTについては、「曖昧なエンドポイント」という批判は当たらない。Q-TWiSTは、生存期間(OS)、無再発生存期間(DFS)、治療期間から計算される「かたいエンドポイント」である。UtやUrを決めるのは患者さんであり、そこに主観が入り込むわけであるが、臨床試験として評価される段階でのデータは、あくまでも客観的なものである。
(2)については、確かにそうだという気もする。プライマリーエンドポイントとして生存期間を評価し、セカンダリーエンドポイントとしてQOLを評価する、というのは多くの臨床試験で普通に行われている。生存期間に関して優劣の差がない場合には、QOLを比較して、意思決定に役立てるわけである。現時点では、これがもっとも現実的な対応であろう。ただし、QOLを生存期間と同等に扱う試みは、生存期間至上主義に対するアンチテーゼとして、今後も続けていくべきだと思う。
(3)については、恣意的なのは事実であるが、患者さんの恣意的な評価まで排除すべきではない。医者の意思決定に使いにくいとしても、患者さんが、自分自身の価値観に照らして意思決定を行うのには有用な考え方である。また、Q-TWiSTが恣意的であるならば、生存期間を絶対的な判断基準としてしまうのも、実は、恣意的なことである。Ut=Ur=1としたQ-TWiSTが生存期間であり、そう考えると、生存期間も、相対的な基準の一つに過ぎないということが浮き彫りになる。「何が何でも長生きすることが大事」と考える患者さんばかりではないということを医者は認識しなければいけない。
以上、「QOLを加味した生存期間」について考察してみた。現時点では、実用的な段階には程遠いが、このような取り組みは、今後も続けられるべきである。生存期間の長さだけで治療のよしあしが語られるのであれば、臨床試験が、医者や研究者の自己満足だけにしかならない危険性がある。臨床試験は、患者さんの幸福を目指して行われるべきであり、そのためには、患者さんの視点に立つことが何よりも重要である。
|